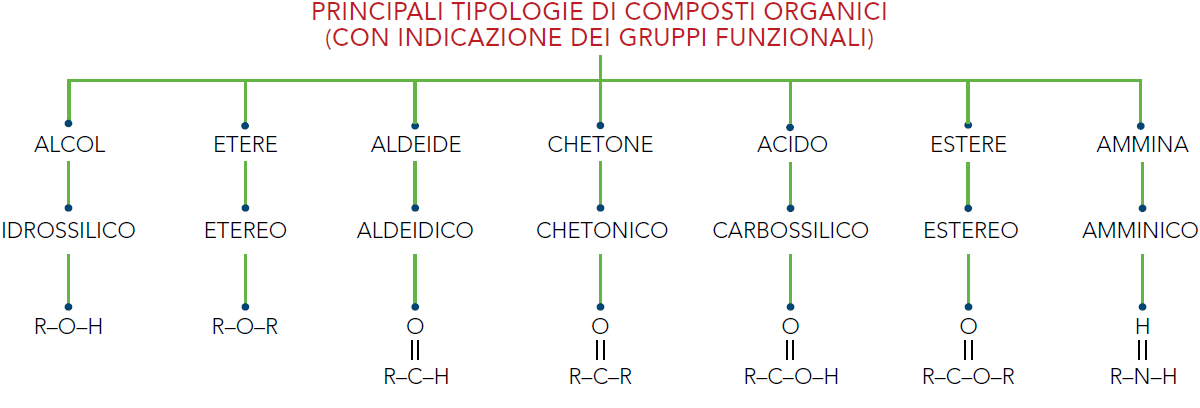
▶ Le reazioni chimiche
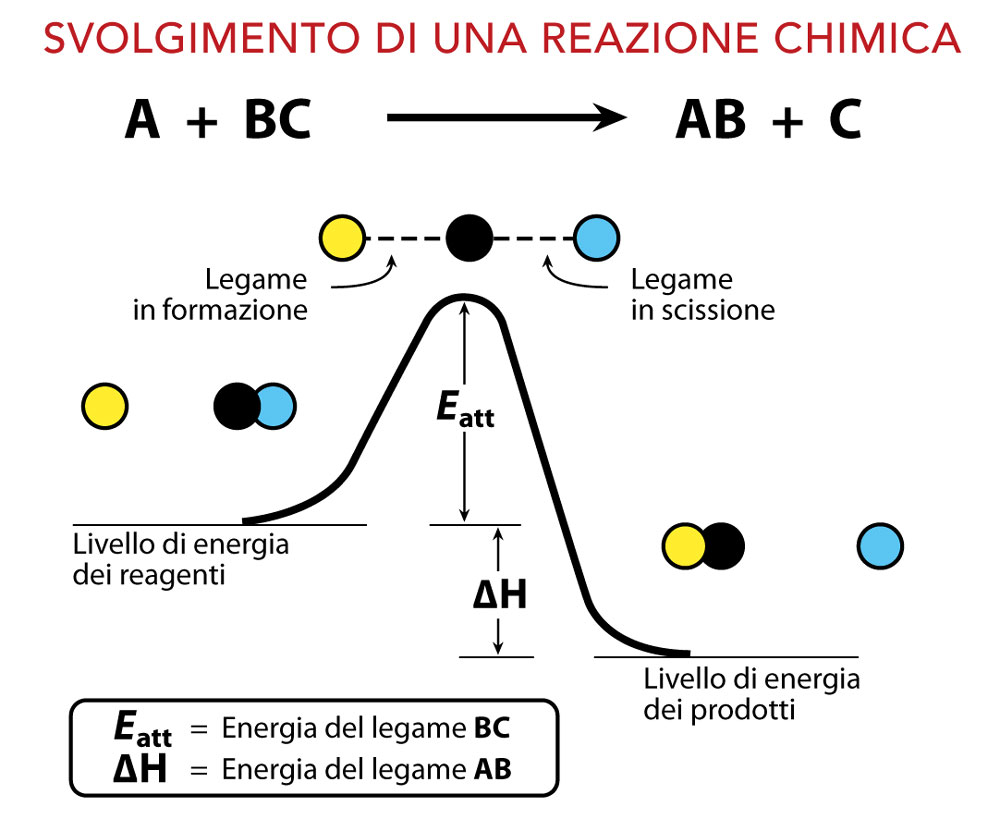
Abbiamo definito la chimica come la scienza che studia la materia e le sue trasformazioni. Le trasformazioni chimiche sono possibili perché atomi e molecole hanno una naturale tendenza ad assorbire o liberare energia scambiandosi elettroni, ridistribuendoli nello spazio in nuove configurazioni più o meno stabili. Ciò avviene sia attraverso la formazione di legami, sia attraverso la loro rottura. Queste trasformazioni della materia sono definite reazioni e vengono rappresentate attraverso equazioni chimiche. In queste equazioni figurano le formule delle sostanze di partenza (reagenti) e quelle delle sostanze ottenute dalla trasformazione (prodotti). La freccia al centro dell’equazione indica la direzione della trasformazione.
| ALCUNE TRA LE PIÙ COMUNI TIPOLOGIE DI REAZIONE | ||
| TIPOLOGIA | CARATTERISTICHE | RAPPRESENTAZIONE SCHEMATICA |
| Reazione di sintesi | i reagenti A e B si uniscono per dare il prodotto C | A + B → C |
| Reazione di scissione | il reagente A si separa nei prodotti B e C | A → B + C |
| Reazione di scambio semplice | il reagente A riceve una frazione del reagente B | A + BC → AB + C |
| Reazione di doppio scambio | i due reagenti si scambiano delle porzioni molecolari | AB + CD → AD + CB |