I PERIODI
Prendiamo ora in esame i periodi, cioè le righe, della tavola periodica, ricordando che in ciascuna troviamo elementi che hanno lo stesso numero di gusci elettronici.
- Il primo periodo: gli elementi più leggeri. Il primo periodo della tavola periodica contiene solo idrogeno ed elio.
L’idrogeno (H) è l’elemento chimico più leggero e tende a disperdersi nello Spazio. Questa è la ragione per cui, anche se molto abbondante, è difficile trovarlo sulla superficie terrestre allo stato libero. È però presente in molti composti, il più importante dei quali è l’acqua (H2O).
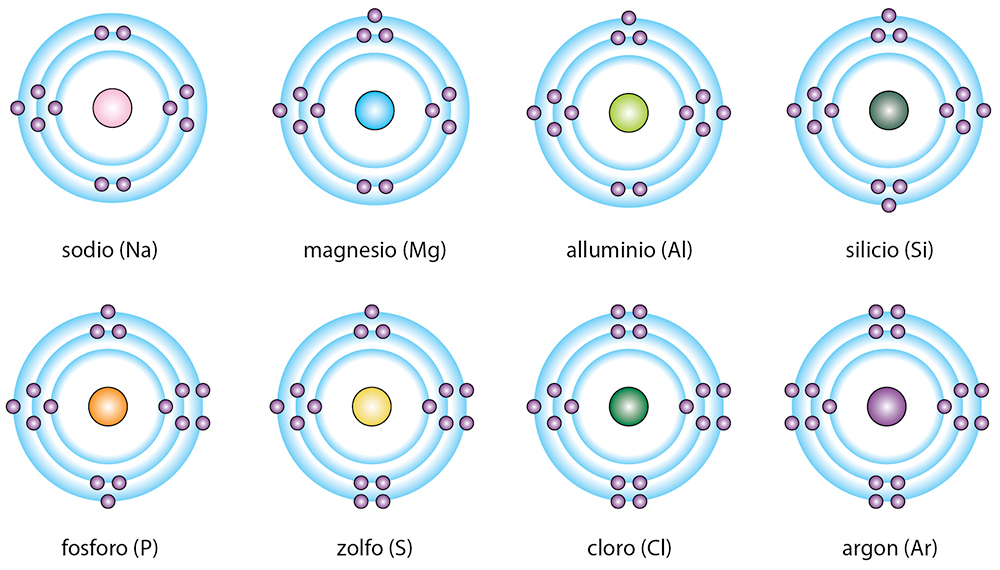
L’elio (He), anch’esso molto leggero (è utilizzato per gonfiare i palloncini che salgono nell’atmosfera), non è presente sulla Terra in grandi quantità, ma è diffusissimo nell’Universo: costituisce il 20-25% del Sole e di tutte le altre stelle (10). Grazie al suo unico guscio elettronico completo con 2 elettroni, l’elio tende a non reagire chimicamente con altri elementi. - Il secondo periodo. Nel secondo periodo sono presenti otto elementi con un numero atomico che va da 3 a 10: litio (Li), berillio (Be), boro (B), carbonio (C), azoto (N), ossigeno (O), fluoro (F) e neon (Ne). Nel loro guscio esterno si trovano, rispettivamente, da 1 fino a 8 elettroni.
A eccezione del neon, gli altri sette elementi hanno il guscio esterno incompleto e tendono quindi a formare composti con altri elementi per completarlo (8 elettroni). Questo “comportamento” vale anche per gli elementi dei periodi successivi, dunque in generale per la maggior parte degli elementi. È per questo che molte delle sostanze che si trovano in natura sono composti.
Due elementi del secondo periodo rivestono una particolare importanza: il carbonio e l’ossigeno.
Il carbonio (Z = 6, con 4 elettroni nel guscio esterno) forma moltissimi composti, tra i quali tutte le molecole fondamentali presenti negli organismi (è infatti considerato “l’elemento della vita”). È inoltre presente nel carbone (11), nel metano e nel petrolio, sostanze derivate dalla lenta trasformazione di resti di organismi.

Secondo periodo