Che cos’è
la tavola
periodica?
Che cosa sono
i periodi
e i gruppi?
Quante sono
le famiglie
di elementi?
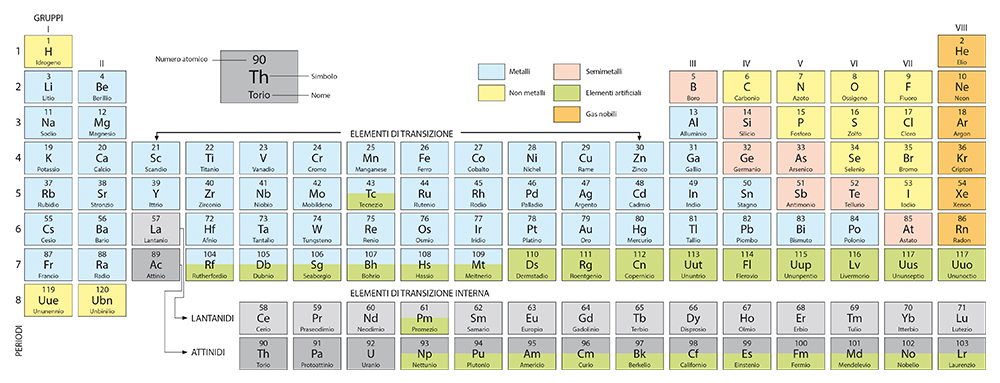
Immagina di ordinare gli elementi chimici uno dopo l’altro in base al loro numero atomico (cioè al numero di protoni che contiene il loro atomo) a partire da quello che ha il numero minore, l’idrogeno (Z = 1). Disponili nello stesso modo in cui scrivi, da sinistra verso destra, e vai a capo ogni volta che gli elettroni hanno riempito un guscio elettronico. Comincerai quindi una nuova riga dopo l’elio (Z = 2), perché il primo guscio è completo con 2 elettroni, e andrai di nuovo a capo dopo il neon (Z = 10), perché il secondo guscio è completo con 8 elettroni (8 + 2 = 10).
È seguendo un criterio di questo tipo che si ottiene la tavola periodica (9), il sistema utilizzato per classificare gli elementi chimici.
La prima versione della tavola periodica fu proposta intorno al 1870 dal chimico russo
Dimitrij Mendeleev, dopo vari tentativi compiuti da altri scienziati. A quei tempi le conoscenze sull’atomo erano ancora scarse, ma Mendeleev riuscì a elaborare un sistema di classificazione che permise di individuare famiglie di elementi con le medesime proprietà chimiche, e addirittura di prevedere l’esistenza di elementi che ancora non si conoscevano e sarebbero stati scoperti più tardi.