Da che cosa
è composto
un atomo?
Che cosa
sono i gusci
elettronici?
Che cos’è
il numero
atomico?
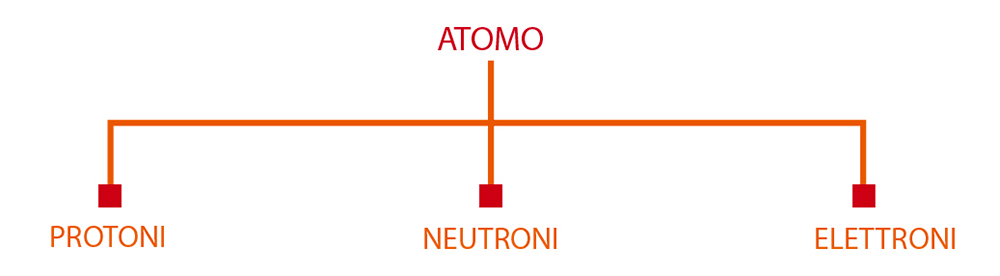
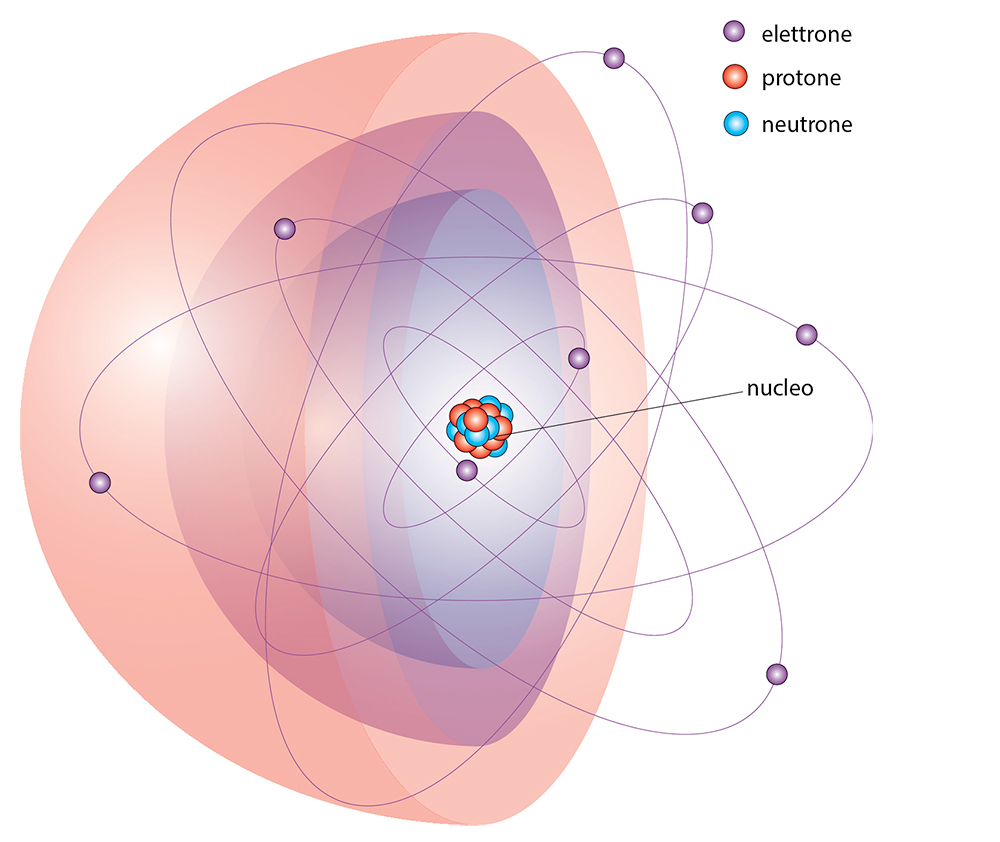
La parola atomo deriva da un vocabolo greco che significa «indivisibile»; a lungo infatti si è pensato che questa particella elementare della materia, che costituisce tutti i corpi, non fosse ulteriormente scomponibile. I progressi della scienza hanno invece consentito di scoprire che gli atomi sono formati a loro volta da particelle ancora più piccole, definite subatomiche: protoni, neutroni ed elettroni.