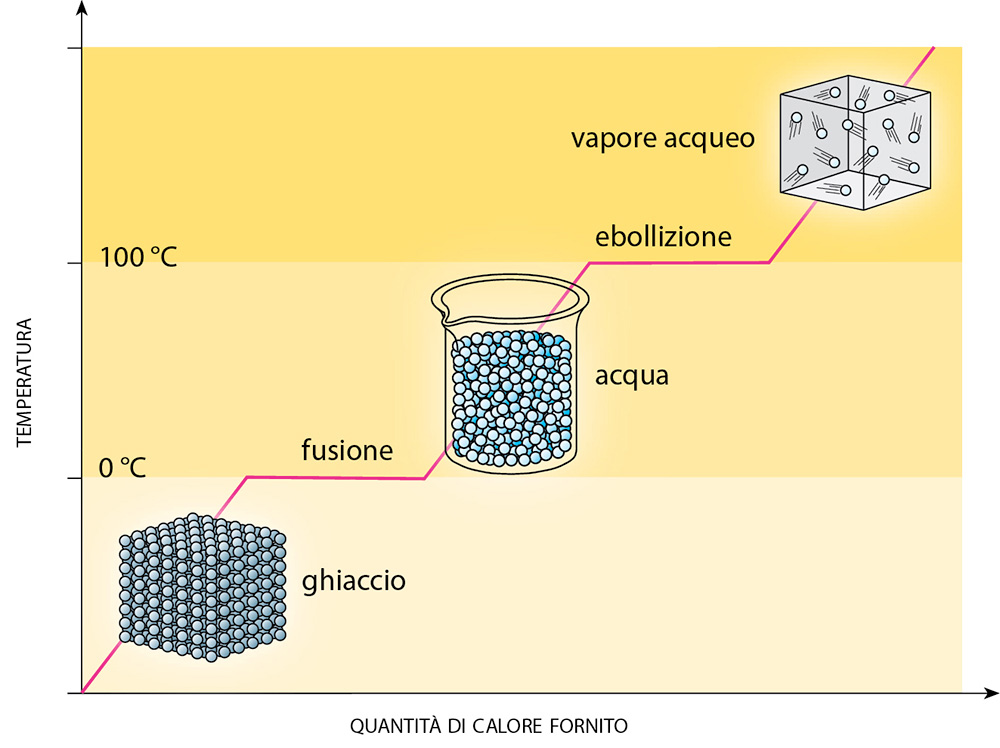
LA FUSIONE E LA SOLIDIFICAZIONE
La fusione è il passaggio dallo stato solido allo stato liquido; il fenomeno inverso, cioè il passaggio dallo stato liquido a quello solido, è chiamato solidificazione.
La fusione avviene perché riscaldando una sostanza le molecole che la compongono si agitano e si spostano sempre più, fino a che, a un certo punto, riescono a vincere le forze di coesione che le tenevano vicine e possono quindi allontanarsi e muoversi più liberamente, con il conseguente passaggio della sostanza allo stato liquido.
La solidificazione è dovuta invece al processo opposto: raffreddando un liquido, le sue molecole perdono energia sino a che le forze di coesione non diventano prevalenti limitandone lo spostamento.
La temperatura a cui una determinata sostanza fonde o solidifica è la stessa, ed è detta
punto di fusione, o di solidificazione: sostanze diverse hanno punti di fusione diversi.