Che cos’è
un'equazione
chimica?
Come
si scrive?
Quando
un'equazione
è bilanciata?
La scoperta della legge di conservazione della massa e di quella delle proporzioni definite, insieme alla sistemazione degli elementi nella tavola periodica, ha permesso ai chimici di stabilire regole precise per rappresentare reagenti e prodotti nelle reazioni chimiche. Per descrivere in modo chiaro e sintetico una reazione chimica si
ricorre infatti a un sistema di simboli detto equazione chimica.
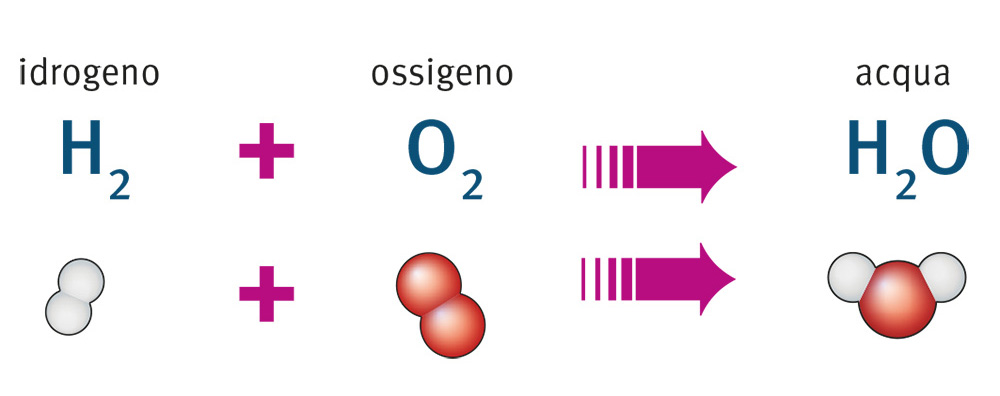
Come abbiamo visto, nella tavola periodica ogni elemento chimico è rappresentato da un simbolo costituito da una o due lettere, che di solito sono l’iniziale del nome latino dell’elemento; per esempio, la H di idrogeno deriva dal termine latino hydrogenium. Per indicare una molecola si usa una formula chimica in cui si scrivono in successione i simboli degli elementi che la costituiscono.
Se compaiono più atomi dello stesso elemento, il loro numero accompagna in basso a destra il simbolo di quell’elemento; per esempio, come abbiamo visto, la molecola dell’acqua è formata da due atomi di idrogeno (H) e da uno di ossigeno (O) e la sua formula è H2O (3).
La molecola di anidride carbonica è formata invece da un atomo di carbonio e due di ossigeno e ha formula chimica CO2: per questo motivo si può chiamare anche diossido (oppure biossido) di carbonio
(4).
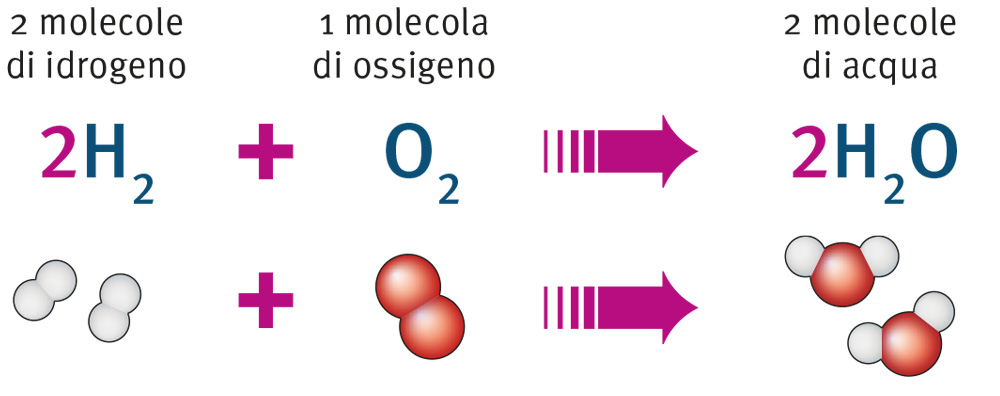
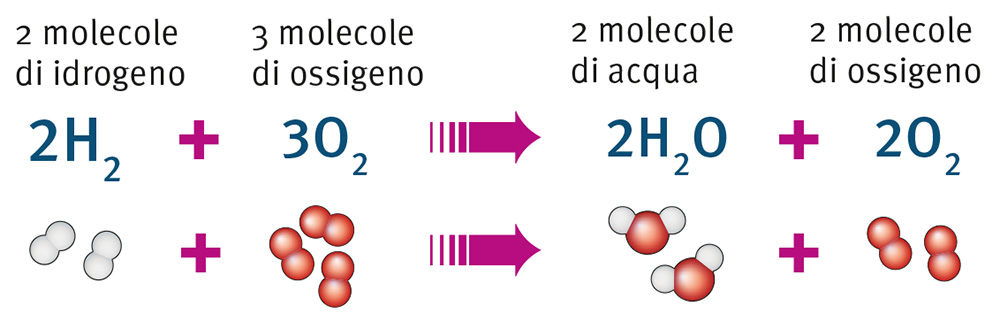
Il processo che si svolge nel corso di una reazione è indicato da una freccia che mostra in quale direzione avviene la trasformazione: a sinistra della freccia si scrivono i reagenti, specificando il numero delle molecole che entrano nella reazione, a destra si scrivono i prodotti, indicando il numero delle molecole che si formano nella reazione.
Come afferma la legge della conservazione della massa, a sinistra e a destra della
freccia è sempre presente lo stesso numero di atomi di ogni elemento, ma le molecole
sono diverse (gli atomi restano gli stessi, ma cambiano le molecole che essi formano).